癌症在一定程度上是一种基因组疾病,几乎所有癌症都存在遗传或者表观遗传的改变, 但目前进入临床指南的癌症表观遗传药物较少。除了该类药物存在较大的细胞毒性和获得性耐药的问题外,很大程度归咎于我们对肿瘤表观遗传的机理认识还不够深入。
组蛋白去甲基化酶KDM5C在多种肿瘤中高频突变或缺失,已有的机制研究多侧重于KDM5C通过其去甲基化酶活性动态调控H3K4me3/H3K4me1比例而影响基因表达。在肿瘤细胞中,KDM5C可通过参与调控DNA损伤修复、厌氧和糖代谢等途径关键基因的表达进而影响肿瘤的发生发展。然而,目前针对KDM5C突变/缺失肿瘤的靶向治疗手段还不清楚。
近日,武汉大学泰康医学院(基础医学院)李枫课题组熊洁副教授在EMBO Reports期刊在线发表题为“Targeting the transcription factor YY1 is synthetic lethal with loss of the histone demethylase KDM5C”的研究论文,揭示了表观遗传因子KDM5C调控转录的新机制,并为鉴定基于合成致死原理的靶标和发展新的靶向治疗策略提供了线索。

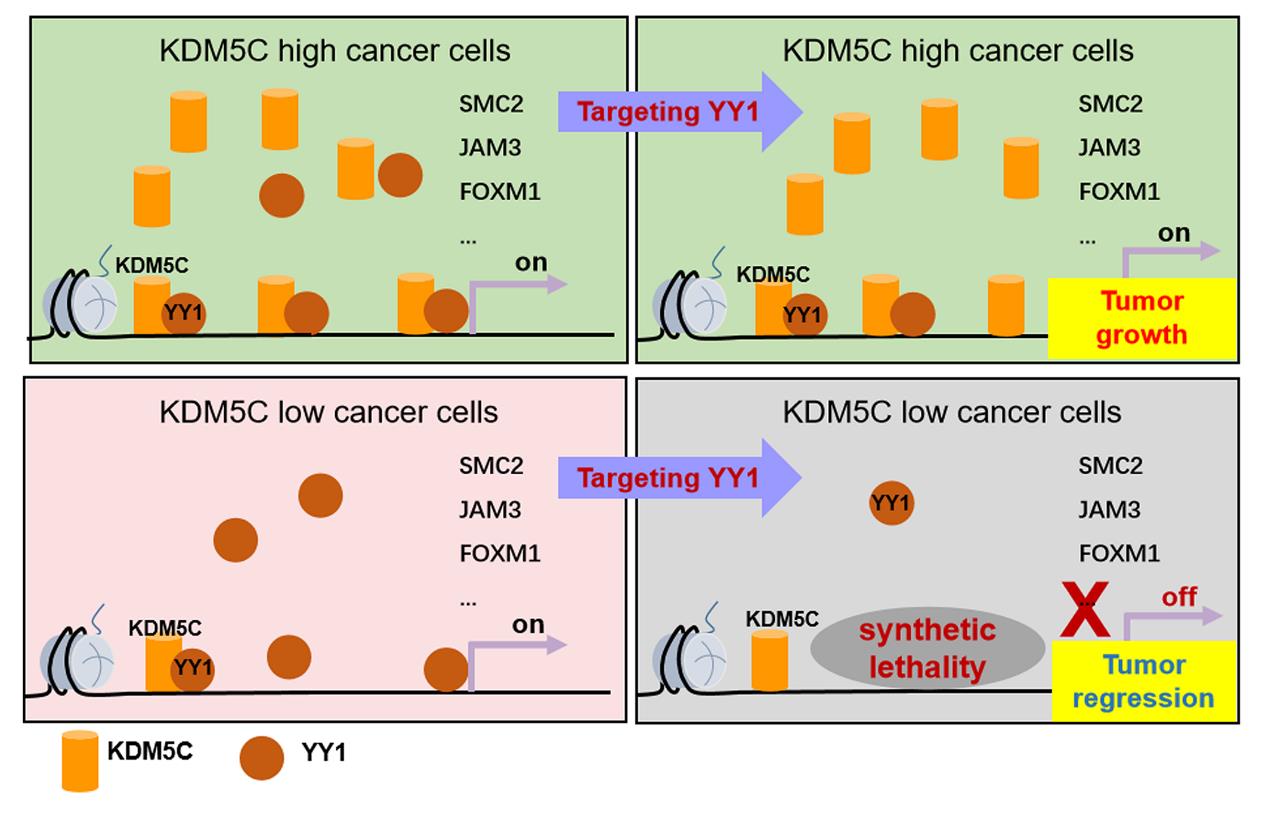
研究通过整合蛋白质组学和功能基因组学分析,发现组蛋白去甲基化酶KDM5C与重要的转录因子YY1存在蛋白相互作用。KDM5C可招募YY1并增加其在全基因组范围内富集,且KDM5C对YY1的招募并不依赖于KDM5C的组蛋白去甲基化酶活性。在细胞和动物水平上,KDM5C基因突变或者低表达的肿瘤细胞对于YY1的缺失更加敏感,提示KDM5C与YY1为一对合成致死基因。该工作发现了表观遗传因子不依赖于其酶活性法的转录方式,提出了转录因子YY1新的招募方式,并为肿瘤的个体化治疗提供了生物标志物和靶向策略。
武汉大学泰康医学院(基础医学院)熊洁副教授,李枫教授和博士生杨凡为本研究论文的共同通讯作者,武汉大学泰康医学院(基础医学院)博士后郑茜,已毕业的博士生李鹏飞(内蒙古医科大学)和强玉龙(复旦大学)为本研究论文的共同第一作者。该研究受到多项国家自然科学基金的资助。
论文链接:https://www.embopress.org/doi/full/10.1038/s44319-024-00290-8
(撰稿:熊洁 审稿:梁凯威)