近日,武汉大学章晓联教授团队在国际学术期刊《自然·通讯》(Nature Communications, IF: 16.6)在线发表题为“EGFR core fucosylation, induced by hepatitis C virus, promotes TRIM40-mediated-RIG-I ubiquitination and suppresses interferon-I antiviral defenses”的论文,章晓联教授和刘敏副教授为该论文的通讯作者,章晓联教授的博士生潘璆为该论文第一作者。
章晓联教授团队早期发现HCV感染能诱导负责蛋白质核心岩藻糖修饰的核心岩藻糖转移酶-FUT8的表达,但其他病毒是否具有类似效应,以及FUT8在病毒感染中的详细机制仍然存在未知。在本研究中,课题组发现多种病毒包膜糖蛋白,包括丙型肝炎病毒E2(HCV- E2)、囊性脊髓炎病毒包膜蛋白(VSV- G)、严重急性呼吸综合征冠状病毒2型刺突蛋白(SARS-CoV-2)和人类免疫缺陷病毒包膜糖蛋白(HIV-gp120)在内的多种病毒包膜蛋白增强了FUT8表达和核心岩藻糖化。HCV-E2通过EGFR-AKT-SNAIL激活操作宿主转录因子SNAIL,诱导FUT8表达。异常增加的FUT8表达促进了TRIM40介导的RIG-I K48泛素化,并通过岩藻糖化的EGFR-JAK1-STAT3-RIG-I信号抑制抗病毒干扰素-I(IFN-I)反应。FUT8抑制剂2FF、EGFR N-糖基化位点特异性突变(Q352AT),以及肝组织靶向Fut8沉默显著增强抗病毒IFN-I反应,抑制RNA病毒复制,表明FUT8介导的核心岩藻糖化对抗病毒天然免疫至关重要。这些发现揭示了病毒的免疫逃逸新机制,即病毒诱导的FUT8通过增强岩藻糖化的EGFR介导激活,抑制内源性RIG-I介导的抗病毒防御。
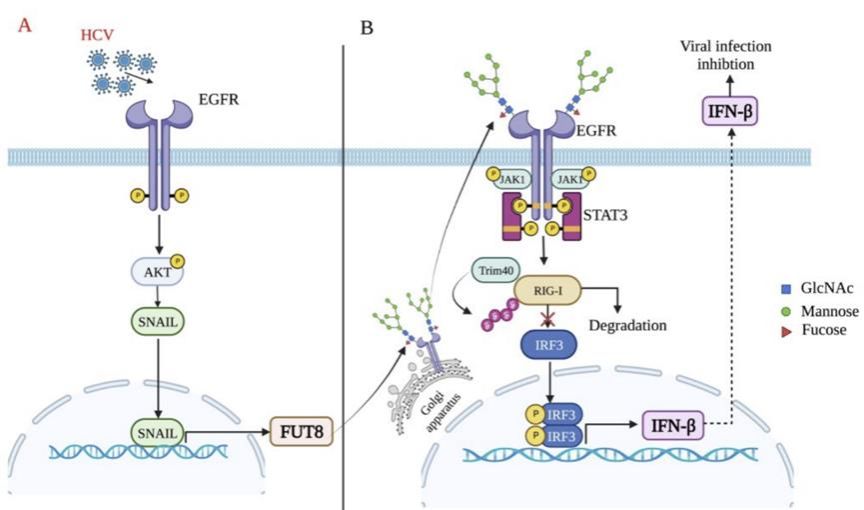
图1 HCV 通过EGFR-AKT-SNAIL通路促进FUT8表达以及FUT8通过EGFR-JAK1-STAT3通路促进HCV的复制示意图。
该研究工作受到国家自然科学基金、国家重点研发计划、科技部重大研发计划和中央高校基本科研业务费资助。
论文链接:https://www.nature.com/articles/s41467-024-44960-6#Sec33